|
已批准上市药物经历了什么?
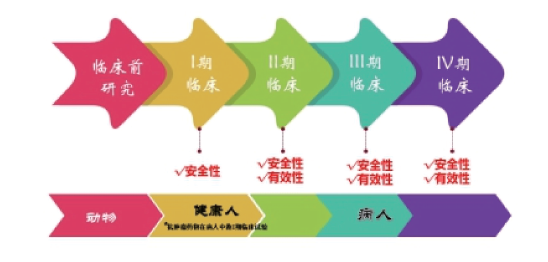
——过五关斩六将的“小药丸”诞生记 上海药品审评核查中心药理临床核查部 孙搏 李先生一直忙于工作, 最近感觉很累晚上却睡不着觉, 神经衰弱, 工作时注意力也集中不了, 于是去医院就诊, 医生给他开了艾司唑仑, 药师仔细交待了正确的服药方法。他回到家, 周围人的说法各种各样, 有人说“是药三分毒, 能不吃药就不要吃药!” 也有人说“有病就得治, 正规医院医生开出的药物放心吃, 这样身体才能好起来”。 药物到底能不能放心吃呢? 吃了药有没有效果? 是不是会有副作用? 我们来看看这一颗颗小药丸是怎么诞生的。 我们在医院拿到的药物, 都是已上市批准销售的药物。药物都必须被证明是安全和有效的, 才能被药品监管部门批准上市, 制药公司才能制造生产、上市销售。首先,科学家们需要在实验室进行动物试验, 发现药物是如何起作用的, 是否是安全的, 如果用到人体上是不是可能有效果, 是否会安全, 我们把这一阶段的研究称为药物非临床研究。很多小动物为人类健康做出了很大贡献。 接着, 开始在人体进行一系列测试以确定药物用于治疗某种疾病是否安全, 是否真正有效果, 这一阶段的研究称为药物临床试验。然后, 制药公司向药品监督管理部门提交这些试验的数据, 用来证明该药物有预期的效果, 并且是安全的。由药品监督管理部门组织审评、核查、检验, 确定药物的健康益处超过其已知风险, 则该药物被批准上市销售。 我们服用的每一种药物都经过临床试验, 那什么是临床试验呢? 药物临床试验, 也被称作新药临床研究, 简单地说就是新药在上市前, 在人体中进行研究, 从中我们可以了解一种新的药物在人体上应用有没有疗效, 有没有副作用,副作用有多大等情况。药物临床试验是评价药物安全性有效性、保障上市药品质量的关键环节和最重要依据, 也是药物研发过程中最重要的环节。无论是在中国, 还是在其他国家, 所有新药在上市前都必须进行临床试验。 临床试验分为四期, 每一期的受试者及试验目的都不尽相同。
药物临床试验分期示意图 I 期临床试验 I 期临床试验主要受试人群是健康志愿者或者是少部分患者, 在安全剂量的范围内, 观察新药在人体中吸收的速度, 在体内如何进行代谢, 需要多长时间代谢排出,人体对该药的反应程度, 这些反应包括好的方面, 也包括坏的方面, 即药物对人体的副作用。通常情况下, 任何严重的副作用可能性都会在动物研究中提前发现, 然而有些副作用在动物身上体现不出来。I 期临床试验受试者服用的剂量刚开始很低, 逐步增加到人体可以承受的最大剂量。 II 期临床试验 II 临床试验会有更多的受试者, 最关注的是药物在目标适应症(某种疾病) 患者中是否有效果。研究人员通常将药物和安慰剂的效果进行对比, 确定有没有效果, 效果有多大。如果一种药物成功闯过II 期临床试验, 是往前迈进很大一步, 因为早期动物实验或体外实验中所表现的有作用有效果, 在人体试验中不一定会看到。 III 期临床试验 参与III 期临床试验会有大量的目标适应症患者, 通常多达上千, 研究者会测试药物到底用多少量能达到最好的效果, 且副作用最小。除了常规测试外, 还要与已有同类药物对比。一旦制药公司或研究者认为他们掌握的药物疗效证据足够有说服力, 他们可以向相关监管部门申请许可。审批过程包括有关部门检查相关证据, 评估药物是否安全、有效, 收益是否大于风险。 IV 期临床试验 在药物批准上市前进行的前三期临床试验是在较小范围、特殊群体的病人中进行的, 病人有很多选择和控制的标准, 因此有很多例外。药物被批准上市后, 会被用到更多的病人中去, 许多不同类型的病人将接受该药品的治疗。所以很有必要继续观察药物在大量病人中使用的安全性和有效性。这时候, 在上市前的临床研究中因发生率太低而没有被发现的不良反应就可能被发现。其中最著名的例子当数沙利度胺(也被称为反应停), 它作为缓解孕妇呕吐的药物获准生产上市, 之后被发现有严重的副作用, 会发生严重的新生儿缺陷(海豹儿), 导致撤回。 讲到这里, 李先生已经明白了已批准上市的药物经历了一段漫长艰辛的过程, 上市销售的药物都是经过许许多多科学家长时间工作研究, 被证明了该药物用于治疗某种疾病的效果超过其可能发生的副作用, 也就是获益大于风险。没有一种药物是绝对安全的和绝对有效果的, 同时, 每一种药物又是相对安全和有效果的。他遵守正确药物服药方法, 睡眠得到很大的改善, 又精神抖擞地投入到工作中去。 |